Bilde 1: Nylon fallskjerm, av Lance Corporal Brian D. Jones, US Marine Corps [Public domain], via Wikimedia Commons.

Redaktørens notat: Nylon er et moderne syntetisk produkt som brukes i produksjonen, mest kjent, av damestrømper, men også en rekke andre varer, fra tau til fallskjerm og bildekk. Nylonase er et populært evolusjonært ikon, som er markedsført av den teistiske evolusjonisten Dennis Venema, blant andre. I en serie på tre innlegg tar Discovery Institute biolog Ann Gauger et grundigere innsyn.
Et betydelig problem for den ny-darwinistiske fortellingen er opprinnelsen til ny biologisk informasjon. Den har tydeligvis blitt økt i løpet av livets historie - nye livsformer dukket opp, som krever nye gener, proteiner og annen funksjonell informasjon. Spørsmålet er - hvordan skjedde det? Dette er det sentrale spørsmålet om opprinnelsen til levende ting.
Stephen Meyer og Douglas Axe har gjort dette sterke kravet -her:
"Den neo-darwinske mekanismen - med sin tillit til et tilfeldig mutasjonssøk for å generere nye gen-sekvenser - er ikke en tilstrekkelig mekanisme til å produsere den informasjonen som er nødvendig for å endog en enkelt ny proteinfold, enda mindre en ny dyreform, i tilgjengelig evolusjonær dyp-tid."
Deres påstand er basert på Doug Axs eksperimentelle funn -her; at funksjonelle proteinfolder er svært sjeldne, i rekkefølge på 1 i 10 til 77. potens, noe som betyr at om alle jordens skapninger søker i løpet av jordens alder, ut fra tilfeldige mutasjoner, så kunne ikke en eneste mellomstor proteinfold finnes.
I kontrast hevder Dennis Venema, professor i biologi ved Trinity Western University, i sin bok 'Adam and the Genome' og i innlegg på BioLogos nettside at det ikke er vanskelig å få ny informasjon. I sin bok presenterer han flere eksempler han mener viser oppdukking av ny informasjon - den tilsynelatende utviklingen av nye proteinbindings-steder, for eksempel. Men den beste måten å avsløre Axes og Meyers dårskap, tror han (og sier det i sin bok og et innlegg hos BioLogos ) ville være å vise at et genuint "nytt" protein kan utvikle seg.
... "Enda mer overbevisende ... ville være et aktuelt eksempel på et funksjonelt protein som kommer fra grunnen - å fange et nytt protein som danner seg 'på fersken,' slik det er. Vi vet om et slikt eksempel - dannelsen av et enzym som bryter ned et menneskeskapt kjemikalie.
 På 1970-tallet fant forskerne en overraskende oppdagelse: en bakterie som kan fordøye nylon, en syntetisk kjemikalie som ikke finnes i naturen. Disse bakteriene levde i avløpsvann av kjemiske fabrikker, og de kunne bruke nylon som sin eneste matkilde. Nylon var imidlertid bare om lag 40 år gammel på den tiden- hvordan hadde disse bakteriene tilpasset seg denne nye kjemikalien i sitt miljø så raskt? Med nysgjerrighet, undersøkte forskerne dette. Det de oppdaget var at bakteriene hadde et enzym (som de kalte "nylonase") som effektivt fordøyet kjemikaliet. Dette enzymet oppstod interessant fra grunnen som en innsettingsmutasjon i den kodende sekvens av et annet gen. Denne innføringen dannet samtidig et "stopp" kodon tidlig i det opprinnelige genet (et kodon som forteller ribosomet å slutte å legge aminosyrer til et protein) og dannet et helt nytt "start" kodon i en annen leseramme. Den nye leserammen virket for 392 aminosyrer før det første "stopp" kodonet, som produserer et stort, nytt protein. Som i vårt eksempel ovenfor, var dette nye proteinet basert på forskjellige kodoner på grunn av rammeskiftet. Det var virkelig "de novo" - en ny sekvens."
På 1970-tallet fant forskerne en overraskende oppdagelse: en bakterie som kan fordøye nylon, en syntetisk kjemikalie som ikke finnes i naturen. Disse bakteriene levde i avløpsvann av kjemiske fabrikker, og de kunne bruke nylon som sin eneste matkilde. Nylon var imidlertid bare om lag 40 år gammel på den tiden- hvordan hadde disse bakteriene tilpasset seg denne nye kjemikalien i sitt miljø så raskt? Med nysgjerrighet, undersøkte forskerne dette. Det de oppdaget var at bakteriene hadde et enzym (som de kalte "nylonase") som effektivt fordøyet kjemikaliet. Dette enzymet oppstod interessant fra grunnen som en innsettingsmutasjon i den kodende sekvens av et annet gen. Denne innføringen dannet samtidig et "stopp" kodon tidlig i det opprinnelige genet (et kodon som forteller ribosomet å slutte å legge aminosyrer til et protein) og dannet et helt nytt "start" kodon i en annen leseramme. Den nye leserammen virket for 392 aminosyrer før det første "stopp" kodonet, som produserer et stort, nytt protein. Som i vårt eksempel ovenfor, var dette nye proteinet basert på forskjellige kodoner på grunn av rammeskiftet. Det var virkelig "de novo" - en ny sekvens."
Bilde 2. Eks. på skift av 'leseramme'
Venema har rett. Hvis nylonase-enzymet utviklet seg fra et fremskiftet protein, ville det virkelig være en demonstrasjon at nye proteiner utvikler seg enkelt. Det ville være et positivt bevis for at intelligente design forkjempere tar feil, at det ikke er vanskelig å få et nytt protein fra tilfeldig rekkefølge. Men historien tåler omprøving. Er det nye proteinet egentlig et produkt av en rammeskift, eller har det eksistert forut for innføring av nylon i miljøet? Hva vet vi nøyaktig om dette enzymet? Danner bevisene grunnlag for påstandene fra Venema og andre, eller fører de til andre konklusjoner?
Først, litt historie. På 1970-tallet oppdaget japanske forskere at visse bakterier hadde utviklet evnen til å nedbryte den syntetiske polymeret nylon -her. Okada et al. Identifiserte tre enzymer ansvarlig for nylon nedbrytning, og kalte dem EI, EII og EIII. Generene som kodet dem ble kalt nylA , nylB og nylC. De sekvenserte plasmidet som genene ble funnet på, og oppdaget at det var et annet gen på det samme plasmidet som var svært lik nylB; De kalt det nylB'. (Vi vil fokusere på historien om nylB og nylB 'fordi det er de som er relevante for Venema's historie.)
 Så langt alt jeg har gitt deg er fakta. Nå her er tolkningen av disse fakta. Noen hevdet at nylonase-enzymet, som det ble kalt, hadde oppstått en stund etter at folk begynte å lage nylon (på 1930-tallet). Det virket plausibelt fordi nylonase ikke klarte å nedbryte naturlig forekommende amidbindinger - det kunne bare nedbryte amid-bindingene i nylon - og det hadde ikke eksistert tidligere, ble det antatt. Den populære konklusjonen var at nylonaseaktiviteten utviklet som svar på nærvær av nylon i miljøet, og således bare var førti år gammel. Og her er det store fortolkende spranget: det må ikke være vanskelig å få nye enzymer hvis et nytt kan utvikle seg innen en periode på førti år.
Så langt alt jeg har gitt deg er fakta. Nå her er tolkningen av disse fakta. Noen hevdet at nylonase-enzymet, som det ble kalt, hadde oppstått en stund etter at folk begynte å lage nylon (på 1930-tallet). Det virket plausibelt fordi nylonase ikke klarte å nedbryte naturlig forekommende amidbindinger - det kunne bare nedbryte amid-bindingene i nylon - og det hadde ikke eksistert tidligere, ble det antatt. Den populære konklusjonen var at nylonaseaktiviteten utviklet som svar på nærvær av nylon i miljøet, og således bare var førti år gammel. Og her er det store fortolkende spranget: det må ikke være vanskelig å få nye enzymer hvis et nytt kan utvikle seg innen en periode på førti år.
Okada et al. Hadde sekvensert genene som koder for nylB og nylB ' . De konkluderte med at nylonase-aktiviteten var resultatet av en genduplisering fulgt av flere mutasjoner til nylB- genet. Men på dette tidspunkt oppdaget Susumu Ohno, en fremtredende molekylærgenetiker og evolusjonær biolog, noe uvanlig om nylB-gensekvensen (Ohno, 1984) -her. Ohno hadde en teori om at DNA med gjentakelser av den riktige typen hadde potensial til å kode for protein i flere rammer, uten noen forstyrrende stoppkodoner, og dermed kunne være en kilde for "nye" proteiner. (Hvis du ikke er kjent med vilkårene jeg nettopp brukte, inviterer jeg deg til å se på dette innlegget, hvor jeg vil forklare de nødvendige konseptene. For de som allerede er kjent, presenterer jeg noen relevante data om sjeldenhet av sekvenser som kan være 'rammeskiftet').
Bilde 3. Tolkning kan avhenge av horisont
Ohno la merke til at nylB, genet for nylonase, kanskje opprinnelig hadde kodet noe annet hvis en bestemt T ble fjernet. Nylonase-genet som det eksisterer, har nå 1179 baser, som koder for et 392 aminosyre-protein. Uten en bestemt T innebygd i ATG-startkodonet, ville sekvensen imidlertid ha spesifisert et hypotetisk original-gen med en lengre åpen leseramme (ORF) på 427 aminosyrer, i en annen ramme. Således foreslo Ohno et "nytt" protein med en ny funksjon som virker på et nytt substrat ble født når en T satt inn mellom en bestemt A og G i DNA, og lage et nytt ATG-startkodon og skifte rammen for å kode for en nytt protein, proteinet vi nå kaller nylonase.
Oppfinnsomt. Ifølge Ohno kunne nylonase være et nytt enzym, som plutselig opptrer uten kjente forløpere via et plutselig 'rammeskift'. (Merk at alt dette forutsetter at nye protein-folder er enkle å få til.) Ohno publiserte denne hypotesen i 'Proceedings of the National Academy of Sciences'. Det var imidlertid bare en hypotese som en nøye lesing av hans artikkel viser. En overskrift, for eksempel:
"R-IIA kodende sekvens [ nylB ] for 6-AHA LOH [nylonase] Embosser en alternativ, lengre åpen leseramme som kunne ha vært den originale kodingsekvensen."
 Og teksten sier:
Og teksten sier:
"Jeg foreslår at RS-IIA- basesekvensen [ nylB ] opprinnelig var en kodende sekvens for en argininrik polypeptidkjede med lengde på ca. 427 og at den kodende sekvensen for én av de to isozymeformene av 6-ALA LOH [ Nylonase] oppstod fra dens alternative åpne leseramme. [Understreking lagt til.]
Ohno presenterte argumenter for hvorfor hans forslag var plausibelt, men ga ikke bevis på at det "originale" genet noen gang eksisterte eller ble brukt (faktisk sier han at det ikke var sannsynlig å være nyttig, basert på aminosyresammensetningen), eller at innsettingen noen sinne skjedde. Ikke desto mindre har rammeskift-hypotesen for nylonase-opprinnelse blitt utbredt som et faktum (men, verdt å merke, ikke av Okada et al. som hadde gjort mesteparten av arbeidet).
Bilde 4. Eks. på polypeptidkjede -med spesifikk 3D-protein forming
Hvis nylonase-historien som nevnt ovenfor var sann, nemlig at en fremdriftsmutasjon resulterte i de novo-generasjonen av et nytt proteinfold med en ny funksjon, ville det faktisk utgjøre en betydelig benektelse av Meyers og Axes krav. Hvis en rammeskiftmutasjon kan produsere en tilfeldig ny åpen leseramme i ekte, observerbar tid og gi opphav til et nytt funksjonelt enzym, må det ikke være så vanskelig å lage nye funksjonelle proteinfolder. Med andre ord, funksjonelle proteinfeller må ikke være sjeldne i sekvensrom. Og derfor må Stephen Meyers argumenter om vanskeligheten med å få nok ny biologisk informasjon til å generere en ny proteinfold, også være feil. Venema hevder fast -her:
"Hvis de novo-proteinkoding-gener som nylonase kan komme fra grunnen, som det var, så er det påvisbart at nye proteinfolder kan dannes av evolusjonære mekanismer uten vanskeligheter. Hvis Meyer hadde forstått de novo gendannelse - som vi har sett, trodde han feilaktig at det var en uforklarlig prosess - så ville han ha visst at nye proteinfolder faktisk kunne utvikles lett av evolusjonære prosesser".
Dunk -rett i kurven, ikke sant?
Litt forsiktighet i å akseptere denne historien uten solid bevis ville være klokt. I genetikk blir det undervist at rammeskift-mutasjoner er ekstremt forstyrrende, og forandrer helt den kodende sekvensen og resulterer i avkortet tull. Faktisk er et uttrykk for en rammeskifts-mutasjon "nonsens-mutasjon." En biologs grunnleggende intuisjon burde være at rammeskift er svært lite sannsynlig i å produsere noe som er nyttig. De eneste grunnene til den utbredte aksepten av Ohnos hypotese som jeg kan komme på, er den uvanlige karakteren til selve sekvensen, Ohno-med rykte som en strålende forsker (som han var) og ønske-oppfyllelse fra noen evolusjonære biologer.
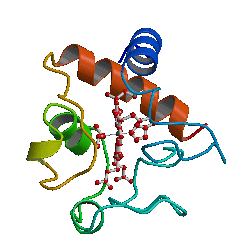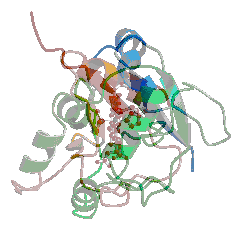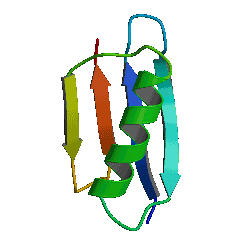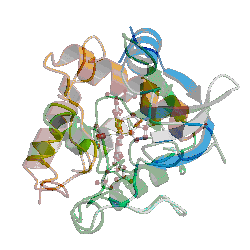 Heldigvis går vitenskapen videre, og bevis fortsatte å samle seg. Den samme gruppen av japanske forskere fortsatte studiet -her. NylB syntes å være resultatet av et gen duplisering av nylB ' som skjedde for en tid tilbake. EII '(enzymet kodet av nylB') hadde svært liten nylonase-aktivitet, mens EII (enzymet kodet av nylB) var ca. 1000 ganger mer virksomt i aktivitet. De to enzymene varierte i aminosyresekvens ved 47 posisjoner ut av 392. Med noe omhyggelig arbeid fastslår japanerne at bare to mutasjoner var tilstrekkelige -her, for å omdanne EII' til EII-aktivitetsnivået.
Heldigvis går vitenskapen videre, og bevis fortsatte å samle seg. Den samme gruppen av japanske forskere fortsatte studiet -her. NylB syntes å være resultatet av et gen duplisering av nylB ' som skjedde for en tid tilbake. EII '(enzymet kodet av nylB') hadde svært liten nylonase-aktivitet, mens EII (enzymet kodet av nylB) var ca. 1000 ganger mer virksomt i aktivitet. De to enzymene varierte i aminosyresekvens ved 47 posisjoner ut av 392. Med noe omhyggelig arbeid fastslår japanerne at bare to mutasjoner var tilstrekkelige -her, for å omdanne EII' til EII-aktivitetsnivået.
De oppnådde deretter den tredimensjonale strukturen -her av et EII-EII ' hybrid-protein . Og med disse resultatene endret alt seg- eller burde ha gjort det.
Her er hva Venema tar fra artikkelen og tolker beviset :
..." den tredimensjonale strukturen av proteinet har blitt løst ved hjelp av røntgenkrystallografi, en metode som gir oss presis form av proteinet i høy oppløsning. Nylonase er stappende full av proteinfolder - akkurat den slags folder Meyer hevder må være et resultat av design, fordi evolusjonen ikke kunne ha produsert dem helt fra livets opprinnelse." [Kursiv lagt til.]
Dessverre har ikke Venema fått historien riktig. Nylonase har en bestemt fold, en bestemt tredimensjonal, stabil form. De fleste proteiner har en tydelig fold det er flere tusen typer folder kjent så langt, hver med en tydelig topologi og struktur. Foldene består vanligvis av små sekundære strukturer kalt alpha-spiraler og beta-tråder, som bidrar til å samle den tertiære strukturen - folden som helhet. Venema virker uklar om hva en proteinfold er, og skillet mellom sekundære og tertiære strukturer. Nylonase er ikke "stappende full av folder". Ingen strukturelle biologer ville beskrive nylonase som "stappende full av proteinfoldinger." Faktisk er ikke noe protein"stappende fullt av folder". Kanskje Venema refererte til de mindre enhetene av sekundær struktur Gauger nevnte ovenfor, alfa-spiraler eller beta-tråder. Men det kunne se ut til at han ikke vet hva en proteinfold er.
Bilde 5. Eks. på protein-foldinger
Kanskje det forklarer hvorfor Venema savnet det viktige punktet i artikkelen som beskriver nylonasens struktur -her. Krystallstrukturen til EII-EII '(en nylonase-hybrid som er nødvendig for å kunne krystallisere proteinet) viste at det ikke er en ny type fold, men et medlem av beta-laktamase fold-familien. Nærmere bestemt ligner den karboxylesteraser, en undergruppe av den familien. I tillegg, da forskerne sjekket EII'og EII, fant de at begge enzymene tidligere hadde uoppdaget karboksylesterase-aktivitet. Med andre ord var EII- og EII-enzymer karboksylesteraser. Hvis det ser ut som en and og kvakker som en and, så er det en and.
Dermed hadde ikke EII 'og EII rammeskiftet nye folder. De hadde allerede eksisterende folder med aktivitet karakteristisk for deres foldetype. Det var ikke noe helt nytt protein. Ingen ny proteinfold hadde oppstått. Og det var ikke nødvendig med noen rammeskift-mutasjon for å produsere nylonase.
 Bilde 6. Nylon-bakterier
Bilde 6. Nylon-bakterier
Hvor kom nylon-spiseevnen fra? Karboksylesteraser er enzymer med brede substrat-specifisiteter; De kan utføre en rekke reaksjoner. Deres bindelomme er stor og kan huse mange forskjellige underlag. De er "promiskuøse" enzymer, med andre ord. Videre hydrolyserer karboksylesterase-reaksjonen en kjemisk binding som ligner den som hydrolyseres av nylonase. Testene viste at både EII og EII 'enzymer har carboxylesterase og nylonase-aktivitet. De kan hydrolysere begge substrater. Faktisk er det mulig at begge hadde karboksylesterase-aktivitet og et lavt nivå av nylonase-aktivitet fra begynnelsen, selv før oppdukkingen av nylon.
NylB' kan være det opprinnelige genet fra hvilket nylB kom. Tilsynelatende var det en gen- duplisering på et tidspunkt i fortiden. De to genene ser ut til å ha ervervet mutasjoner siden da - de varierer med 47 aminosyrer ut av 392. Tidspunktet for dupliseringen er ukjent, men ikke nylig, fordi det tar tid å akkumulere så mange mutasjoner. Imidlertid må minst noen av disse mutasjonene gi et høyt nivå av nylonase-aktivitet på EII, enzymet laget av nylB. Enzymet EII' laget av nylB' har bare en lav evne til å nedbryte nylon, mens EII nedbryter nylon 1000 ganger bedre. Så én eller flere av disse 47 aminosyreforskjellene må være årsaken til det høye nivået av nylonase-aktivitet i EII. Gjennom nøyaktig arbeid, har de japanske forskerne Kato et al. identifisert hvilke aminosyreendringer som var ansvarlige for den økte nylonaseaktiviteten. Bare to trinnvise mutasjoner tilstede i EII, når de ble introdusert i EII', kunne konvertere det svake enzymet EII' til full nylonase-aktivitet.
Fra Kato et al. (1991) :
"Våre studier viste at blant de 47 aminosyrene som var forandret mellom EII og EII' proteiner, var en enkelt aminosyresubstitusjon ved posisjon 181 avgjørende for aktiviteten av 6-aminoheksanoat-dimerhydrolase [nylonase] og substitusjon ved posisjon 266 forbedret effekten."
Så. Dette er ikke historien om et svært usannsynlig rammeskift som produserer et nytt funksjonelt enzym. Dette er historien om et eksisterende enzym med et lavt nivå av "promiskuøs" nylonaseaktivitet, som forbedret aktiviteten mot nylon ved første anledning, deretter en annen selekterbar mutasjon. Med andre ord er dette et helt sannsynlig tilfelle av gen duplisering, mutasjon og valg som opererer på et eksisterende enzym for å forbedre en eksisterende lavnivå-aktivitet, akkurat den typen begivenhet som Meyer og Axe spesifikt anerkjenner som en mulighet, gitt tid og probabilistiske ressurser tilgjengelig. Faktisk er opprinnelsen til nylonase et godt eksempel på optimalisering av en eksisterende folds funksjon, ikke innovasjonen eller opprettelsen av en ny fold.
 Som forskerne som utførte strukturbestemmelsen -her, selv bemerket det:
Som forskerne som utførte strukturbestemmelsen -her, selv bemerket det:
"Her foreslår vi at aminosyreutskiftninger i katalytisk spalte av en tidligere eksisterende esterase med beta-laktamasefolden resulterte i utviklingen av nylonoligomer-hydrolasen." [Understreking lagt til.]
Bilde 7. Noen tar for hardt i her
La oss skrinlegge fabelen at nylonoligomer-hydrolasen EII, allment kjent som nylonase, oppsto ved en rammeskiftmutasjon, noe som førte til etableringen av en ny funksjonell proteinfold. Det er absolutt ikke nødvendig å postulere en så usannsynlig hendelse, og ingen begrunnelse for å hevde dette ekstravagante kravet. I stedet er det en mye mer alminnelig forklaring - at nylonase oppstod av et gen dupliserings-arrangement en gang tidligere, etterfulgt av en serie av to mutasjoner som oppstod etter introduksjonen av nylon i miljøet, noe som økte nylonoligomerhydrolase-aktiviteten til NylB-genprodukt til nåværende nivå. Kunne denne hendelsesserien skje i løpet av førti år? Ja visst. Sannsynligvis på mye kortere tid. Faktisk har det blitt rapportert å skje i laboratoriet under de rette selektive forholdene. Og absolutt, utviklingen av nylonase kaller ikke på opprettelsen av en ny proteinfold, heller ikke oppsto en. EII's fold er en del av carboxylesterase-foldfamilien. Karboksylesteraser tjener mange funksjoner og har eksistert mye lenger enn førti år.
Douglas Axe og Stephen Meyer innrømmer lett at denne typen evolusjonære tilpasning skjer lett. Et protein som allerede har lavt aktivitetsnivå for et bestemt substrat, kan muteres for å favorisere den sidereaksjonen over den opprinnelige, ofte i få trinn. Det er mange tilfeller av dette i litteraturen. Hva Axe og Meyer hevder er at generering av en helt ny proteinfold via mutasjoner og naturlig seleksjon er ekstremt usannsynlig. Ingenting i nylonase-historien som Dennis Venema forteller, viser noe annet.
Bakgrunnsstoff: "Nylonase historien: Hvor uvanlig er det?"
Oversatt av Asbjørn E. Lund
(Bildene sto ikke i opprinnelig artikkel, evt. untatt det 1., og er satt inn av undertegnede, se lenke i Bilde-nr)

 På 1970-tallet fant forskerne en overraskende oppdagelse: en bakterie som kan fordøye nylon, en syntetisk kjemikalie som ikke finnes i naturen. Disse bakteriene levde i avløpsvann av kjemiske fabrikker, og de kunne bruke nylon som sin eneste matkilde. Nylon var imidlertid bare om lag 40 år gammel på den tiden- hvordan hadde disse bakteriene tilpasset seg denne nye kjemikalien i sitt miljø så raskt? Med nysgjerrighet, undersøkte forskerne dette. Det de oppdaget var at bakteriene hadde et enzym (som de kalte "nylonase") som effektivt fordøyet kjemikaliet. Dette enzymet oppstod interessant fra grunnen som en innsettingsmutasjon i den kodende sekvens av et annet gen. Denne innføringen dannet samtidig et "stopp" kodon tidlig i det opprinnelige genet (et kodon som forteller ribosomet å slutte å legge aminosyrer til et protein) og dannet et helt nytt "start" kodon i en annen leseramme. Den nye leserammen virket for 392 aminosyrer før det første "stopp" kodonet, som produserer et stort, nytt protein. Som i vårt eksempel ovenfor, var dette nye proteinet basert på forskjellige kodoner på grunn av rammeskiftet. Det var virkelig "de novo" - en ny sekvens."
På 1970-tallet fant forskerne en overraskende oppdagelse: en bakterie som kan fordøye nylon, en syntetisk kjemikalie som ikke finnes i naturen. Disse bakteriene levde i avløpsvann av kjemiske fabrikker, og de kunne bruke nylon som sin eneste matkilde. Nylon var imidlertid bare om lag 40 år gammel på den tiden- hvordan hadde disse bakteriene tilpasset seg denne nye kjemikalien i sitt miljø så raskt? Med nysgjerrighet, undersøkte forskerne dette. Det de oppdaget var at bakteriene hadde et enzym (som de kalte "nylonase") som effektivt fordøyet kjemikaliet. Dette enzymet oppstod interessant fra grunnen som en innsettingsmutasjon i den kodende sekvens av et annet gen. Denne innføringen dannet samtidig et "stopp" kodon tidlig i det opprinnelige genet (et kodon som forteller ribosomet å slutte å legge aminosyrer til et protein) og dannet et helt nytt "start" kodon i en annen leseramme. Den nye leserammen virket for 392 aminosyrer før det første "stopp" kodonet, som produserer et stort, nytt protein. Som i vårt eksempel ovenfor, var dette nye proteinet basert på forskjellige kodoner på grunn av rammeskiftet. Det var virkelig "de novo" - en ny sekvens." Så langt alt jeg har gitt deg er fakta. Nå her er tolkningen av disse fakta. Noen hevdet at nylonase-enzymet, som det ble kalt, hadde oppstått en stund etter at folk begynte å lage nylon (på 1930-tallet). Det virket plausibelt fordi nylonase ikke klarte å nedbryte naturlig forekommende amidbindinger - det kunne bare nedbryte amid-bindingene i nylon - og det hadde ikke eksistert tidligere, ble det antatt. Den populære konklusjonen var at nylonaseaktiviteten utviklet som svar på nærvær av nylon i miljøet, og således bare var førti år gammel. Og her er det store fortolkende spranget: det må ikke være vanskelig å få nye enzymer hvis et nytt kan utvikle seg innen en periode på førti år.
Så langt alt jeg har gitt deg er fakta. Nå her er tolkningen av disse fakta. Noen hevdet at nylonase-enzymet, som det ble kalt, hadde oppstått en stund etter at folk begynte å lage nylon (på 1930-tallet). Det virket plausibelt fordi nylonase ikke klarte å nedbryte naturlig forekommende amidbindinger - det kunne bare nedbryte amid-bindingene i nylon - og det hadde ikke eksistert tidligere, ble det antatt. Den populære konklusjonen var at nylonaseaktiviteten utviklet som svar på nærvær av nylon i miljøet, og således bare var førti år gammel. Og her er det store fortolkende spranget: det må ikke være vanskelig å få nye enzymer hvis et nytt kan utvikle seg innen en periode på førti år. Og teksten sier:
Og teksten sier: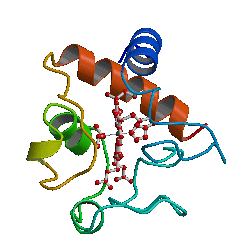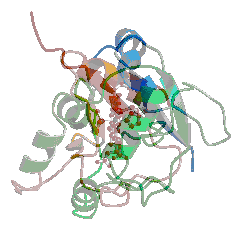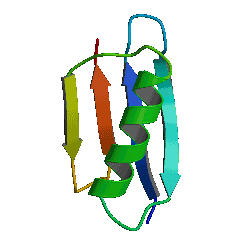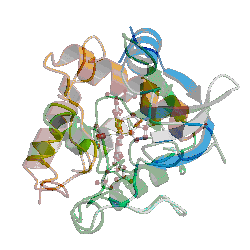 Heldigvis går vitenskapen videre, og bevis fortsatte å samle seg. Den samme gruppen av japanske forskere fortsatte studiet -her. NylB syntes å være resultatet av et gen duplisering av nylB ' som skjedde for en tid tilbake. EII '(enzymet kodet av nylB') hadde svært liten nylonase-aktivitet, mens EII (enzymet kodet av nylB) var ca. 1000 ganger mer virksomt i aktivitet. De to enzymene varierte i aminosyresekvens ved 47 posisjoner ut av 392. Med noe omhyggelig arbeid fastslår japanerne at bare to mutasjoner var tilstrekkelige -her, for å omdanne EII' til EII-aktivitetsnivået.
Heldigvis går vitenskapen videre, og bevis fortsatte å samle seg. Den samme gruppen av japanske forskere fortsatte studiet -her. NylB syntes å være resultatet av et gen duplisering av nylB ' som skjedde for en tid tilbake. EII '(enzymet kodet av nylB') hadde svært liten nylonase-aktivitet, mens EII (enzymet kodet av nylB) var ca. 1000 ganger mer virksomt i aktivitet. De to enzymene varierte i aminosyresekvens ved 47 posisjoner ut av 392. Med noe omhyggelig arbeid fastslår japanerne at bare to mutasjoner var tilstrekkelige -her, for å omdanne EII' til EII-aktivitetsnivået. Bilde 6. Nylon-bakterier
Bilde 6. Nylon-bakterier Som forskerne som utførte strukturbestemmelsen -her, selv bemerket det:
Som forskerne som utførte strukturbestemmelsen -her, selv bemerket det: